環境DNA測定において、生息する生物が検出されない可能性(ウイルス査で言う偽陰性)と生息しない生物が検出される可能性(ウイルス検査で言う擬陽性)は極力減らす必要があります。ただ偽陰性は感度の関係から必ず出るものであり、多くの方は擬陽性に重点的に注意を払っているように感じています。
もし生息することは分かっていて、どの程度生息しているのかの測定(定量測定)を行うのであれば、偽陰性の方によりに注意を払う必要が出てくると思います。と言いますのは、コンタミでその生物のDNAが混じってもほんの少量であり、測定しようとしている濃度と比較して(よっぽどの混入をしない限り)誤差レベルとなります。
一方偽陰性に関しては(ここではDNAが減ることを意味しますが)不適切な処理を行うとすぐに数分の一程度の検出量になってしまいます。
その一つの例を以下の実験に示します。
【実験】
あるコイの生息する池の水を500mLのカップで採水し
1:そのカップから直接50mLシリンジで吸い上げステリベクスで濾過
2:カップの水をペットボトルAに入れ、約1時間後にステリベクスで濾過
3:カップの水をペットボトルBに入れ、約1時間後にステリベクスで濾過
濾過後はただちに冷凍。
ここでペットボトルAはこれまで何度も環境水を汲んで使っているもので水道水で3回洗浄し、現場で共洗いしたもの。
ペットボトルBは水道水で洗浄後、ハイターを入れて洗浄した後3回水道水で洗浄。使用前に共洗いしたもの
その他の条件は
・ステリベクスによる濾過量(500mL)
・キアゲン法による抽出
・KAPA 3G Plantを使用した試薬を使用
・PicoGnen-PCR1100 による増幅
【結果】
結果は以下のようになり、その時の増幅曲線を下図に示します。
1: Ct=41.0
2: Ct=41.0
3: Ct=42.8
明らかにハイター洗浄したものはCt値が大きく、DNA量が減っていることを示しています。つまりこの洗い方はハイター洗浄後の洗い流しが不十分でDNAを破壊してしまったと考えられます。
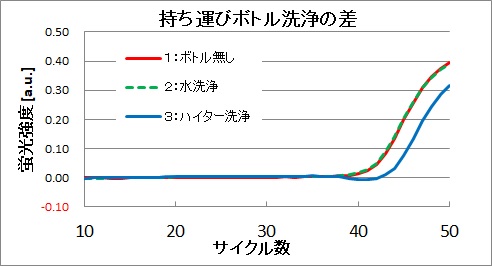
学会のマニュアルではバケツをハイターで洗浄することになっています。これは擬陽性をなくす測定には必要と思いますが、定量測定を行う場合には要注意です。不適切なハイター洗浄をした場合、データがばらつく可能性があります。
では適切な洗浄法とはどのような手順なのか?これについては現在思案中です。ご存じの方があれば連絡頂きたいと思っています。
ちなみに私はこれまでの実験の目的から定量測定を行うことが多いのでハイターの洗浄はしないことが多いです。
追記
2020年8/26に環境DNA学会主催の「採水・濾過」関係のセミナーがあり、「ハイターの洗浄基準」に関する質問がありました。
学会の主な役員が回答者として出席されていましたが、残念ながらクリアな洗浄基準(ハイターの洗い流し基準)は無さそうです。ただ一つの目安として水を入れて泡が立たなくなればよいと考えているとのコメントもありました。北大で現場での採水を多く経験されている荒木先生は実験室ですべての採水機材を洗い、ハイターもきっちり洗い流したものを現場で使うとのこと。例えば5か所で採水する場合は洗ったバケツを5ヶ持っていくほど徹底されているようです。
この問題はだれかがきっちりデータで示し、環境DNA測定の信頼性を確保する必要がありそうです。
⇒データをお持ちの方は教えてください。
