最近開発したビリューチップを使用したろ過&抽出法(ビリューチップ法/BC法)は、学会のマニュアルにあるキアゲン社のキットを使用した方法(学会法と呼んでます)と比べて圧倒的に手順は簡単で誰にでもできます。

一方で簡単だけど効率はどうかと言う疑問を持つ方も多いと思いますので、eDNA濃度が検出限界付近のサンプル水を使用して両方法でどの程度の確率で検出されるかを試してみました。
方法は次の通り
まず学会法の抽出効率を100%と仮定した時にニジマスのeDNA濃度が20copies/mL程度になるサンプルを作ります。これはニジマスの水槽水を学会法で一度ろ過&抽出を行った後ディスクトップ型のPCR装置(StepOne)にて定量PCRを行い、その結果から希釈率を計算し20copies/uLになる基準サンプルを作りました。
この基準サンプルをさらに純水で1/10、1/20、1/40と希釈し、希釈前の基準サンプルと純水含めて5水準の溶液を作り、これを次の条件でろ過&抽出しました。ろ過&抽出の回数は希釈前の基準サンプルと純水は2回、その他は3回実施しました。
| 学会法 | BC法 | |
| ろ過部材 | ステリベクス | ビリューチップ |
| ろ過量 | 200mL | 10mL |
| 抽出方法 | 学会マニュアルによる (キアゲン社キット使用) | ビリュー法標準 (or論文参照) |
| 抽出液量 | 200uL (BufferAEの量) | 20uL |
| 濃縮率 | 1000倍 | 500倍 |
抽出後のサンプルはStepOneにてニジマスを対象に3繰り返しのPCRを行い9回(or6回)中、何回検出されたかをカウントしました。
結果を次の表とグラフに示します。
| 希釈率 | 推定濃度 copies/mL | ろ過抽出回数 | 学会法 検出回数 | BC法 検出回数 | 学会法 検出率[%] | BC法 検出率[%] |
| 基準 | 20 | 2 | 6/6 | 6/6 | 100 | 100 |
| 1/10 | 2 | 3 | 2/9 | 8/9 | 20 | 89 |
| 1/20 | 1 | 3 | 2/9 | 4/9 | 20 | 44 |
| 1/40 | 0.5 | 3 | 2/9 | 3/9 | 20 | 33 |
| 純水 | 0 | 2 | 0/6 | 0/6 | 0 | 0 |
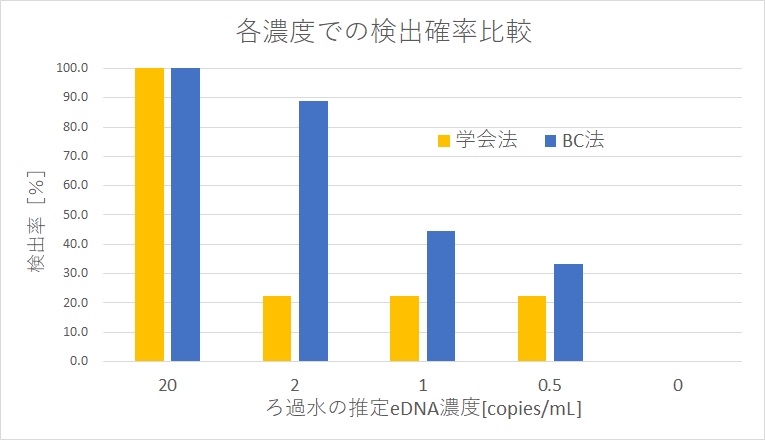
今回の結果からBC法の操作手順は簡単であるにも関わらず検出限界は学会法と比較して悪くはない事が判ります。しかも今回は濃縮率が学会法の半分でも同等(以上)の検出限界になっていました。
まだまだ色んなサンプルを検出してみて確認をする必要はありますが、なかなか使えそうです。
ビリューチップに興味がある方は「お問い合わせ」からコンタクトください。