環境DNAの検出を行う場合、多くの場合なるべく高濃度の抽出液を得たいと思うはずです。
ここでは高濃度に抽出するためのヒントになるデータがありますので紹介します。
学会のマニュアルに記載されているキアゲン社キット(DNeasy Blood and Tissue)を使用してDNAを抽出する場合、最後に投入するElution Buffer(Buffer-AE)の量は200uLとなっています。一方マニュアル作成時に参照された宮先生の文献では100uLを使用したと書いています。
この差が結果にどのように現れるかを実験してみました。
方法はアユ釣りが解禁された相模川の水を持ち帰り、その日のうちにステリベクスで200mLずつ濾過。これを学会マニュアルの手順で抽出。ただし最後のBuffer-AEの量を20uL~200uLまで振りました。こうして得られた抽出サンプルをアユをターゲットにPCR装置(StepOne)で3繰り返し測定し、その時の濃度[コピー数/uL]を出しました。ちなみにネガコンとして純水を同量ステリベクスしたものも測定し非検出を確認しています。
結果は図-1の通りAEの量が減ると濃度は高くなっています。今回の結果では濃度upは50uLが限界のようになっていますが、実際には50uLでもAEをカラムに投入する時に細心の注意が必要でした。なぜなら確実にカラムのフィルタに滴下させないといけないからです。20uLではそれができませんでしたのでDNA濃度が下がったものと考えられます。
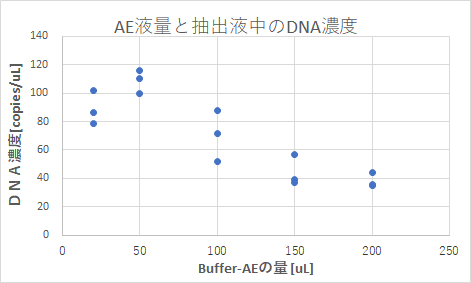
もしDNAの全量が抽出さているならy=a/xの関係になっているはずですが、そこから逸脱しているのはやはり少量のAEでは完全にカラムから回収できていないことを示しています。つまり抽出するDNA量を多くしたい場合(何度もPCRをする場合)は多量のAE(例えば200uL)で抽出。抽出したDNA濃度を高くしたい場合(限られた回数のPCRを行う場合)は少量のAE(例えば100uL)で抽出を行えばよいと考えられます。
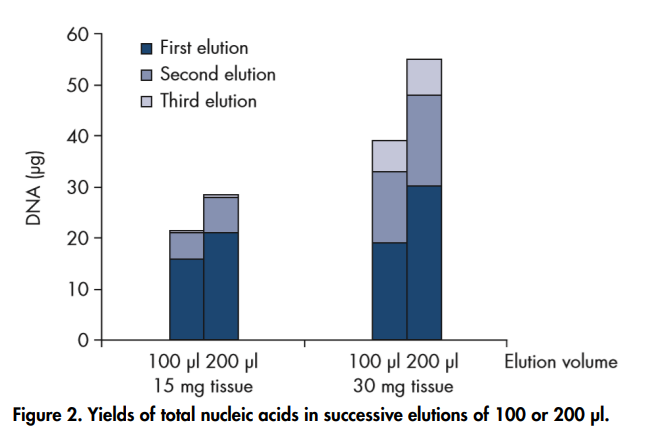
この現象はキアゲンのハンドブックにある図-2に示すグラフからも読めとけます。
特に元のDNA量が多い場合は、多くのDNA量を回収しようとすると200uLがBetterであることが分かります。今回の相模川の結果は右側のグラフに近い結果になっているように思えます。
一方で高濃度で抽出したいという方は100uLもしくは頑張って50uLで抽出するのがよいかもしれません。